行业趋势二——药品生产企业的供给侧改革,看好高品质仿制药结构性机会
多重政策推动国产高品质仿制药和国产创新药加速进口替代国内用药结构仍有较大调整空间,进口多、中药注射剂多,疗效确切、临床急需的创新药、高品质仿制药较少。 016 年全国药品市场外企市场销售额占比 24%、国产占比 76%,销售额前 20 名的药品中以化学药、中药注射剂为主,和全球销售前 20 的药物多数为肿瘤用药、生物药形成明显对比。我们认为国内用药结构仍有很大调整空间,疗效确切、临床急需的创新药、高品质仿制药较少。 随着新版医保目录&谈判目录、一致性评价和优先审评等政策推进,未来国内整体用药结构有望升级,高品质国产仿制药和国产创新药占比有望不断提升。
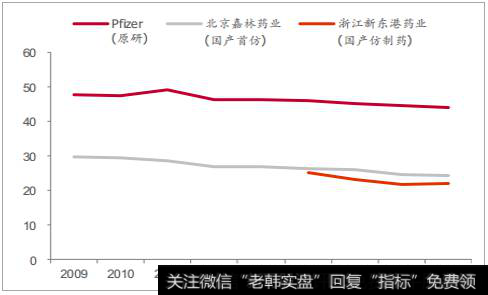
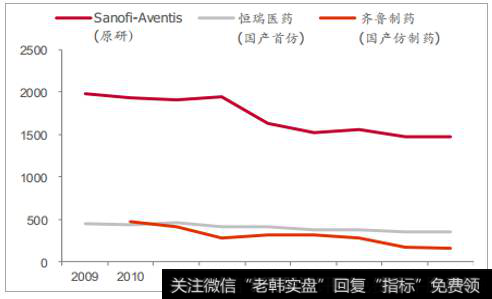
国产仿制药价格约为原研的 25%-70%之间左右,近年来逐步实现部分进口替代。 我们统计了阿托伐他汀、氯吡格雷、阿卡波糖和多西他赛 4个典型品种近几年来原研和国产的价格、销售数量格局情况。多西他赛国内生产企业较多、国产价格低(原研的 25%),国产占据 90%左右的销售数量份额,原研销售数量份额仅为 10%。其余品种国产企业相对较少,国产价格在在原研的 50%-70%之间,原研保有一定份额的销售数量,近几年来呈现出逐步被国产取代的趋势,如阿托伐他汀国产占比从2010 年的 21%提高到 2016 年的 27%,氯吡格雷 33%到 52%(2 家),阿卡波糖 19%到 36%(2 家)。未来随着国产高品质仿制药完成一致性评价,竞争格局进一步优化,国产进口替代有望加速。
阿托伐他汀中标价格走势图(元/盒<10mg*7>)
氯吡格雷终端销售数量格局

氯吡格雷中标价格走势图(元/盒<75mg*7>)

阿卡波糖终端销售数量格局

阿卡波糖中标价格走势图(元/盒<50mg*30>)

多西他赛中标价格走势图(元/支<0.5ml:20mg>)
CDE 改革推进药品审评审批速度不断加快。 过去国内药品上市前的申请周期极为漫长、药品审评积压问题严重, 2015 年以来 CDE 通过集中审评、优先审评等方式不断改革加快审评效率,逐步显现出成效。我们梳理近几年国内药品申报注册及完成审评情况,可以看到 2015-2016年 CDE 承办药品逐年下降, 2016 年减少了 55%左右, 3735 个的数目也远远低于前五年每年 CDE 承办的受理号数量;而 2015-2016 年完成审评任务数目逐年显著上升, 2016 年同比增长 26%,等待审评任务数目显著下降至原先的一半。分类别看,化药 ANDA、进口再注册和补充申请时间明显缩短,分别缩短 5.57%、 46.02%和 23.21%;治疗性生物制品各审评类别时长均显著下降。2017 上半年 CDE 承办药品注册申请数目也呈现明显趋势, 2119 个受理号相比 2016 上半年 2258 个下降了 139 个,化药 1676 个(下降),生物制品 289 个(上升),中药 138个(基本持平)。
2017 年上半年药品注册申报情况(单位:个)

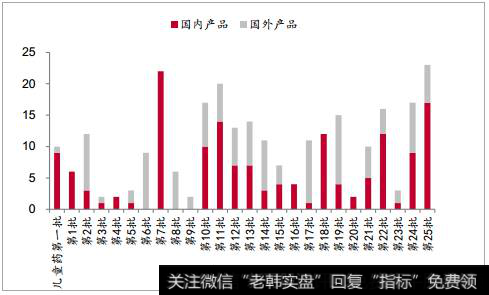
新药审评办法加速国产产品升级,目前已公布 25 批优先审评名单。2016年 2 月 26 日 CFDA 发布了《关于解决药品注册申请积压实行优先审评审批的意见(2016 年第 19 号)》,重点支持三大类药物的优先审评,规定了 17 种情形可以进行优先审评。2016 年至今优先审评制度高效落实,随政策推进纳入优先审评品种数目显著增多。优先审评实现有限的审评资源向创新药和临床急需品种倾斜,减少其排队时间,创新药审评加速进行,创新药物、高品质仿制药将受益。 东阳光(14 个)、恒瑞(14 个)和正大天晴(11 个)优先审评数占比靠前。
纳入优先审评药物类别

截止第 25 批纳入优先审评品种情况(单位:个)
优先审批平均审评时间(单位:天)












